“双极硫酸盐化理论”可以描述为:铅蓄电池在放电时,正负极的活性物质均变成硫酸铅( PbSO4 ),充电后又恢复到原来的状态,即正极转变成二氧化铅( PbO2) , 负极转变成海绵状铅(Pb)。
( 1 )电动势的产生
铅蓄电池正极板上的活性物质是二氧化铅,负极板上的活性物质是海绵状铅。在稀硫酸溶液中,由于电化学作用,正、负极板与电解液之间分别产生了电极电位,正、负两极间电位差就是蓄电池的电动势。负极板.上的海绵状金属铅是由二价铅离子( Pb2+ )和电子组成的。稀硫酸在水中被电离为氫离子( H+)和硫酸根离子( S04 )。负极板浸入稀硫酸溶液后,二价铅离子进入溶液,在极板上留下能自由移动的电子,因而负极板带负电,即产生了电极电位。同样,正极板.上的二氧化铅也与这样,在电池的正、负两极上便产生了电动势。稀硫酸作用,产生的四价铅正离子( Pb4+)留在极板上,使正极板带正电,也产生了电极电位。
( 2 )放电过程中的电化学反应
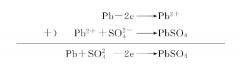
①负极的电化学反应在放电过程中 ,负极上的铅原子失去两个电子,变成二价铅正离子( Pb2+ )。电解液中的硫酸分子( H2SO4 )离解为两个氢离子(H+)和一个硫酸根离子( S04 )。此时二价铅正离子( Pb2+ )与一个硫酸根离子结合成硫酸铅( PbSO4 )分子,附着在负极板上。两个氢离子( H+ )留在电解液中,参加正极化学反应。负极板失去的电子将通过外电路流入正极。化学反应方程式如下:
②正极的电化学反应放电开始后 ,正极上的PbO2与电解液中的水分子作用,生成四价铅离子( Pb4+ )和四个氢氧根离子(OH )。每个四价铅离子接受负极传来的两个电子后生成Pb2+,再进入溶液与硫酸根(SO4 )结合成硫酸铅分子( PbSO4 )附在正极上,氢氧根离子(OH- )与溶液中氢离子( H+ )反应生成水分子。反应式如下:
③铅蓄电池放电过程中总的电化学反应将负极的电化学反应与正极的电化学反应两式相加,就得到铅蓄电池放电过程中的总反应方程式。铅蓄电池放电过程中的电化学反应示意图如图5 -3所示。
不断生成,电解液密度不断升高。因此,电解液密度可以作为电池充电终了的标志,如启动用铅蓄电池的充电终了密度是ds=1.28 ~ 1.30kg/L ,固定用防酸隔爆式铅蓄电池的充电终了密度是d15=1.20~ 1.22kg/L。
④充电后期分解水的反应铅蓄电池在充电过程中还伴随有电解水的反应,这种反应在充电初期很微弱,但当单体电池的端电压达到2.3V/只时,水的电解开始逐渐成为主要反应。这是因为端电压达2.3V/只时,正负极板上的活性物质已大部分恢复,硫酸铅的量逐渐减少,使充电电流用于活性物质恢复的部分越来越少,而用于电解水的部分越来越多。此时,负极板.上有大量氢气冒出,正极板上有大量氧气冒出。其化学反应方程式如下:
对于富液式铅蓄电池来说,此时可观察到有大量气泡逸出,并且冒气越来越激烈,因此可用充电末期电池冒气的程度作为充电终了标志之一。但对于阀控式密封铅蓄电池来说,因为是密封结构,其充电后期为恒压充电( 2.3V/只左右) , 充电电流很小,而且正极析出的氧气能在负极被吸收,所以不能观察到冒气的现象。水的分解不仅使电解液减少,而且浪费电能,同时激烈气泡的冲击能加速活性物质脱落,使蓄电池寿命缩短。因此,充电后期须减小充电电流,减缓冒气的剧烈程度,以延长电池寿命。